
深圳市某医疗科技有限公司创建于2020-01-14 。主要经营范围为一般经营项目是:一类医疗器械的销售、电子医疗仪器、外置除颤仪的技术开发;货物或技术进出口。,许可经营项目是:第二、三类医疗器械生产与经营拥有1-20人,企业性质为有限责任公司所属分类为深圳市移动互联网行业。 瑞恩尼本次为企业提供国内III类GMP体系辅导,从GMP体系导入、转化、实施到现场核查陪审。并成功协助企业通过国家局现场核查。现企业已获得国家局颁发的“半自动除颤仪医疗器械注册证”。恭喜企业获证,祝产品大卖!!
414
深圳市某科技有限公司,总部位于深圳市南山区,是一家以科技融合时尚产品为驱动力的智能硬件公司。公司主营智能硬件研发与高端个护产品生产,旗下品牌专注于科技美容仪器研发制造,涵盖脱毛仪、光子美容仪等品类。 本次瑞恩尼协助该企业获IPL脱毛仪沙特SFDA认证证书,打开了该产品在沙特的市场。预祝企业产品销售长虹!
525
深圳市XX医疗器械有限公司成立于2010年,是一家集压缩式雾化器、雾化吸入耗材、吸痰器、睡眠呼吸治疗仪、红外线体温计及上述产品配套零配件的研发设计、生产制造、销售服务为一体的专业化企业。目前公司拥有150多名员工,月生产能力15万台。 企业秉承“自由呼吸,全民健康”的质量方针不断开拓进取,一直致力于健康呼吸类产品的创新研发,为全球病人提供最佳疗效的呼吸道疾病治疗。 企业恪守“技术铸就品牌,质量构筑信誉”的宗旨以创新、品质、信誉、服务确保为全球客户提供高可靠性的医疗器械产品。 公司现拥有30余项专利,已通过SGS ISO13485医疗器械质量体系认证,欧盟CE产品认证,国内GMP医疗器械质量体系认证。在2010年荣获迪士尼合格供应商,并在2017年一次性通过美国FDA审核无观察项企业。 公司严格执行国内、国际质量体系法律法规要求,产品远销美国、俄罗斯、德国、意大利和巴西,中东,东南亚等50多个国家和地区,受国内、外用户与客商的肯定和赞誉。 本次瑞恩尼辅导企业压缩式雾化器和网式雾化器的CE MDR认证咨询服务,在瑞恩尼专业老师的不懈努力和企业的相互配合下,顺利获得由SGS颁发的MDR证书(该证也是瑞恩尼咨询代理的第16张证书)。这标志着企业产品符合欧盟最严格的合规认证,也标志着企业产品合规上市。预祝企业在目前的大环境下,力争上游,产品销售长虹!
776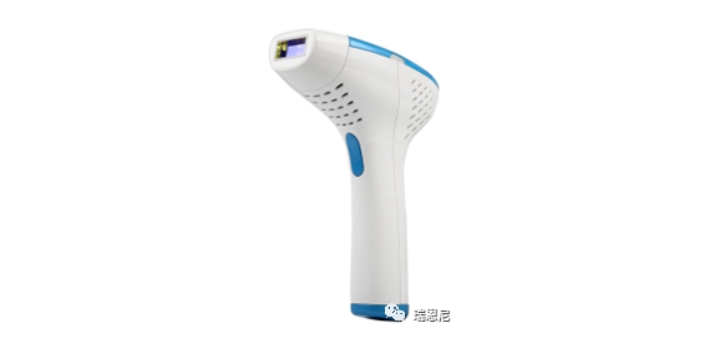
喜报!瑞恩尼助力同一企业3个510(k)零缺陷获批 东莞客户与瑞恩尼合作的医疗器械510(k)注册项目圆满收官,三个产品均以零缺陷佳绩成功获批: 首款IPL脱毛仪:2024年4月率先获批,审核全程无缺陷; 激光生发帽:2025年2月初提交,仅用85天高效获批; 第二款IPL脱毛仪:虽因FDA审核员变更延长至98天,仍保持零缺陷通过。 三项注册均未触发正式发补,彰显团队专业性与协作效率,完美达成合同目标。 IPL脱毛仪简介 l IPL脱毛仪用于永久性减少成人毛发再生。全身可用(如腋下,四肢,下巴线以下的面部毛发) l 工作原理:IPL脱毛仪发出特定波长的脉冲光,被深色毛发中的黑色素吸收后转化为热能,破坏毛囊毛乳头,抑制毛发再生。 l 分类:FDA II类医疗器械(Product Code:OHT) 激光生发帽简介 用途:适用于成人雄激素性脱发(AGA)治疗,通过低能量激光疗法(LLLT)刺激毛囊,促进毛发再生。 工作原理:生发帽采用LLLT技术,通过650纳米波长的5毫瓦低能量激光,可穿透头皮表层3-5毫米深度直达毛囊区域。同时诱导内皮生长因子分泌,促进新生毛细血管形成,为毛囊提供更丰富的营养供给,增强毛囊细胞活性,改善局部血液循环,从而延缓脱发并促进毛发新生。 分类:FDA II类医疗器械(Product Code:OAP)。 核心难点: 法规符合性挑战:需严格满足21 CFR 878.4810对光疗设备的特殊控制要求,涉及光学安全、生物相容性等关键测试,历史审评中此类问题发补率极高。 测试风险集中:光学安全(如IEC 62471)和生物相容性(ISO 10993)是FDA重点审查项,同类产品常因测试方法或数据完整性不足被要求补充数据。 破局策略: 精准预判审评路径: 联合瑞恩尼等专业机构提前介入,通过等同器械(Predicate Device)比对分析,明确产品分类与合规路径,减少审评分歧。 发补风险前置化解: 基于FDA对同类产品的发补问题库,反向优化技术文档,针对性补充测试数据,确保“一次提交通过”。 建立“免疫式文档”体系,通过模拟审评逻辑闭环(如测试标准→数据→结论→标签声明的一致性),杜绝逻辑断层。 光疗产品FDA 510(K)专项清单 光学/能量安全合规: 符合IEC 62471光生物安全测试(蓝光危害、视网膜热损伤等)、IEC 60601-2-83家用光疗设备特殊要求(能量限制、故障保护)及IEC 60825-1激光安全标准等。 可用性工程验证: 模拟FDA人因工程场景,覆盖用户误操作(如非预期照射、设备倾斜使用)的风险控制验证,确保说明书警示有效性。 等同器械论证: 构建多维度对比模型(波长范围、能量密度、适用部位),结合Predicate Device论证实质性等同(SE)。 技术文档闭环管理: 采用“法规-标准-测试-文档”四维校验,确保数据链闭合。 标签/说明书合规性优化:按21 CFR 801/809.10规范修订警告语、禁忌症及符号标识,避免因表述模糊导致发补。
843
瑞恩尼助力江苏某企业获得营养管路CE MDR认证证书! 攻坚克难,携手突破: CE MDR是欧盟针对医疗器械颁布的最新法规,以临床安全性、技术合规性和全生命周期监管为核心,认证标准严苛、流程复杂。为助力企业高效完成认证,我司组建专业团队,从产品临床评价、CE技术文档优化、质量管理体系升级(增加MDR QMS)提供全流程咨询服务。 精准对标法规:协助企业梳理MDR技术文档,完善风险管理(ISO 14971)、可用性工程(IEC 62366& IEC60601-1-6)及临床评价证据; 快速响应整改:针对公告机构(SGS1639)提出的技术疑问,提供数据补充和合规策略支持; 里程碑意义此次认证的通过,不仅彰显了企业产品的技术领先性与国际市场竞争力,也为中国医疗器械行业突破欧盟技术壁垒树立了标杆。未来,该系列产品将服务于欧洲医疗机构,惠及全球患者,同时为企业拓展海外市场奠定坚实基础。
757
喜报! 瑞恩尼助力吸鼻器企业再获FDA 510(k)零发补,43天获证! 本次FDA 510(k)是瑞恩尼助力企业获得的第35个零发补案例!! 一、电动吸鼻器简介 l 电动吸鼻器用于间歇清除儿童(2-12岁)的鼻分泌物和粘液。本设备用于家庭环境。 l 工作原理:电动吸鼻器利用电机泵在吸入系统中产生 负压,使鼻分泌物流入装置容器。 l 分类:FDA II 类医疗器械(Product Code: BTA) 二、电动吸鼻器FDA 510(k)注册心得 在电动吸鼻器 510 (k) 申请过程中,瑞恩尼团队凭借丰富的合规经验与精细化项目管理,攻克多项关键挑战,最终实现零发补快速获批。 三、注册经验分享: 产品说明书:FDA 的法规和指南是 510 (k) 注册的基石,其要求细致且严格。在准备注册材料时,我们对各类相关标准和指南进行了深入研究。例如,产品说明书不仅要符合 ANSI/AAMI ES 60601 - 1 等电气安全标准,还要遵循 FDA 关于医疗器械患者标签的指南要求。我们需要根据电动吸鼻器的独特设计,清晰、准确且简洁地描述产品特性和操作方法,确保逻辑清晰无歧义。这就要求我们逐字逐句地核对每一项内容,确保符合法规的每一个细节。 包装标签:对于产品外包装彩盒,要严格避免夸大产品的功能和特点,确保宣传内容真实可靠。FDA 非常重视产品宣传的真实性,任何虚假或误导性的宣传都可能导致注册失败。因此,我们在设计外包装时,严格按照产品的实际性能和特点进行描述,不做任何夸大其词的表述。 性能测试:电动吸鼻器在国外并没有现成的行业标准,这就需要我们根据产品的特性,结合丰富的经验,制定出完全符合产品设计和特性的测试报告。在性能测试方面,我们涵盖了负压精度、噪音水平、电池续航等多个关键指标。每一项测试方法和测试要求都经过了反复推敲和验证,确保测试结果的准确性和可靠性。 数据真实性:为了保证数据的真实性和完整性,我们与具备 CNAS、GLP 资质的第三方实验室合作,进行符合标准的各项测试。 符合标准清单: l 电气安全:ANSI/AAMI ES 60601-1 l 电磁兼容:IEC 60601-1-2 l 家用环境: IEC 60601-1-11 l 生物相容性:ISO 10993-1 l 软件:IEC 62304 l 锂电池安全: IEC 62133-2
604